#8H. Ions Positifs -- Histoire
Les ions et la chimie
La notion d'ions voit d'abord le jour en chimie. Au 19ème siècle il était bien connu que l'eau dans laquelle des sels ont été dissous (ou des acides, ou des bases) est conductrice d'électricité, et qu'inversement un courant électrique peut séparer ces matériaux dissous en leurs composants. Faraday en a formulé les lois.
Mais comment se fait-il, et pourquoi ?
La réponse fut donnée en 1884 par Svante Arrhenius (1859-1927), un Suédois talentueux, prix Nobel 1903 de chimie, qui a évoqué pour la première fois (parmi ses nombreuses autres trouvailles ) "l'effet de serre ". Arrhenius a montré que si un composé comme le NaCl ( sel de table, chlorure de sodium) est dissous dans l'eau, il se décompose en "ions" (en grec : "ce qui bouge") électriquement chargés, Na+ et Cl-. Les forces électriques font que les ions Na+ se déplacent dans une direction, les ions Cl- à l'opposé, ce qui produit un courant électrique.
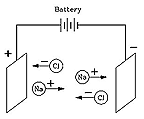 Bien que cela ait d'abord semblé une idée étrange, elle est maintenant tout à fait bien comprise. De nombreuses molécules chimiques sont formées par mise en commun des électrons des atomes, mais les molécules du type NaCl sont différentes. Ici, l'atome de sodium (Na) abandonne un électron au chlore (Cl), ce qui donne des ions Na+ et Cl -, normalement, à l'état solide, liés par leur attraction électrique. Mais l'eau affaiblit considérablement cette attraction (à l' échelle microscopique), permettant aux ions de migrer librement quand le sel y est dissous :l'eau devient conductrice
Bien que cela ait d'abord semblé une idée étrange, elle est maintenant tout à fait bien comprise. De nombreuses molécules chimiques sont formées par mise en commun des électrons des atomes, mais les molécules du type NaCl sont différentes. Ici, l'atome de sodium (Na) abandonne un électron au chlore (Cl), ce qui donne des ions Na+ et Cl -, normalement, à l'état solide, liés par leur attraction électrique. Mais l'eau affaiblit considérablement cette attraction (à l' échelle microscopique), permettant aux ions de migrer librement quand le sel y est dissous :l'eau devient conductrice
Les ions dans un plasma
Dans le plasma d'un gaz raréfié des décharges d'ions (comme ceux des tubes fluorescents) se produisent également. J.J. Thomson, qui découvrit l'électron, créa plus tard (1907-11) d'étroits faisceaux de protons dans un milieu proche du vide dont il étudia les réaction aux forces magnétiques et électriques.
Aujourd'hui, bien sur, des faisceaux de proton sont produits coutumièrement et accélérés à des énergies très élevées, dans des machines gigantesques comme le "Tevatron" au sud de Chicago et les accélérateurs du CERN ( Centre Europe pour la Recherche Nucléaire) près de Genève. On peut avec certains d'entre eux, dirigés et se brisant sur des cibles, étudier la structure de la matière et produire diverses "nouvelles" particules. Un autre mode "plus propre" de les étudier consiste à provoquer une collision frontale entre un faisceau de protons et des antiprotons, particules d'"antimatière" ressemblant à des protons mais dont la charge est négative. La collision proton-antiproton est plus propre parce qu'elle n'implique que deux particules relativement simples, mais il faut d'abord produire des antiprotons par d'autres collisions de grande énergie, puisqu'ils n'existent pas habituellement dans la nature.
Les ions issus de la Radioactivité
La radioactivité a été découverte en 1895, quand il fut constaté que les éléments lourds tels que l'uranium émettaient des "rayons" susceptibles d' ioniser l'air et de voiler le film photographique. En 1898 Ernest Rutherford remarqua que ce rayonnement semblait se partager en deux composants de signes électriques opposés, orientés par un aimant en directions opposées -- les rayons positifs "alpha" et les rayons négatifs "bêtas."
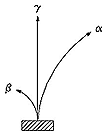
Ultérieurement les rayons bêtas ont été assimilés aux électrons et les "particules alpha" aux noyaux d'hélium complètement ionisés. Un troisième composant, "les rayons gamma" non déviés par les aimants, se sont avérés être liés à la lumière et aux rayons X. Le prix Nobel 1908 a été attribué à Rutherford pour ses travaux sur la radioactivité.
Particules Alpha
On s'aperçut ensuite que les noyaux lourds comme l'uranium sont rendus instables du fait de leur grand nombre de protons (étant tous positifs, les protons se repoussent). De tels noyaux expulsent donc certains de leurs protons supplémentaires sous forme de particules alpha, qui (c'est remarquable) forment une configuration extrêmement stable. Les particules alpha libérées par les roches souterraines retrouvent finalement des électrons et deviennent des atomes habituels d'hélium, dispersés dans la croûte de terre. Une autre partie de cet hélium devient un gaz naturel qui peut être extrait pour des utilisations très diverses. C'est ainsi que pratiquement tout le gaz hélium utilisé dans le passé pour les ballons-jouets était issu d'un rayonnement alpha !
En savoir plus :
- "Des rayons X aux Quarks" d'Emilio Segre, une histoire de la physique moderne, y compris celle de la radioactivité et des accélérateurs. Clairement et cordialement écrit par un lauréat de prix Nobel, mais pas toujours facile pour le non-scientifique.
- "La particule de Dieu" de Leon Lederman avec Dick Teresi, la même histoire racontée par un autre prixNobel, mais dans un style plutôt allègre et impertinent.
- Un exposé élémentaire sur la physique nucléaire peut être trouvé dans le site jumelé avec l'"exploration de la magnétosphère de la terre"
"Exploration of the Earth's Magnetosphere", intitulé "
From Stargazers to Starships," (traduction en francais: Des observateurs aux explorateurs du ciel )dans section sur l'énergie solaire net la section suivante, optionelle sur l'énergie nucléaire.
Questions des lecteurs (anglaise) :
***
When and how were positive ions discovered?
|